SNF har beslutat att det 2021 ska ordnas ett digitalt möte ”Neurologidagarna” som får vara substitut i väntan på att Neurologiveckan återuppstår 2022. Föreningen kommer att göra sitt yttersta för att det digitala mötet ska bli en neurologikonferens av högsta klass och erbjuda minst lika bra fortbildning som ett fysiskt möte. Digitala mötesplattformar blir bättre och bättre och en stor fördel är att fler får möjlighet att delta utan resa.
Mutationer i neurochondringenen kopplas till epilepsi
Mutationer i genen för neurochondrin kan bidra till att epilepsi, försenad språkutveckling och utvecklingsstörning uppstår. Mutationen innebär en genförändring som kraftigt försämrar kontakter och signalöverföring mellan nervcellerna i hjärnan. Det visar en ny studie, ledd från Uppsala universitet, som publiceras i tidskriften American Journal of Human Genetics.
– Mutationen kan vara ytterligare en förklaring till varför människor drabbas av de här tillstånden och som kan göra det lättare att diagnosticera drabbade individer. Det här är vanliga åkommor som ofta upptäcks hos barn i förskoleåldern. De väcker oro och frågor hos föräldrar till de drabbade barnen: Beror det på något fel under graviditeten, förlossningen eller under tidig uppväxt? Var det något fel på våra könsceller och är det ärftligt? Mutationerna som vi har hittat uppstår ibland i enstaka könsceller innan själva befruktningen. Det är då en slump att de råkar träffa neurochondringenen och ger de här effekterna, säger Niklas Dahl, överläkare och professor vid institutionen för immunologi, genetik och patologi vid Uppsala universitet.
Studien, som har letts från Uppsala universitet, började med analys av en världsomspännande databas med information om genetiska analyser av hela arvsmassan. Forskare och läkare från hela världen rapporterar in avvikelser i arvsmassan som de stöter på hos patienter eller i forskningen. På det sättet går det att se om det någonstans i världen finns något annat liknande fall. I Uppsala hade forskarna först identifierat tre fall med mutation i neurochondrin-genen.
I studien hittade forskarna ytterligare tre barn från olika världsdelar som hade drabbats av mutationer i en och samma gen . Hälften av barnen hade ärvt mutationen (det krävs anlag från båda föräldrarna) och för hälften hade den uppstått i enstaka könsceller.
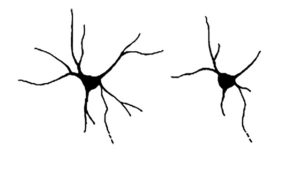
Forskarna har undersökt vad mutationen gör. I hjärnan finns det tusentals komplexa nätverk av nervceller. Varje nervcell har många utskott, ”förgreningar”, för att kunna nå andra nervceller och kommunicera med varandra. I studien visar forskarna att nervceller med neurochondrin-mutationer har färre och kortare utskott jämfört med nervceller utan mutationer (bild 1).
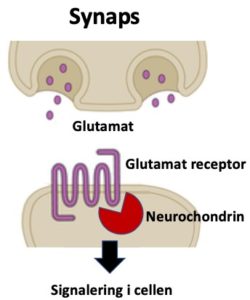
Mutationerna gör att nervcellerna inte utvecklar tillräckligt många utskott för att nå andra nervceller som de måste fungera tillsammans med. Enkelt förklarat minskar kontaktvägarna mellan nervcellerna så att de inte kan prata med varandra. Neurochondrin hjälper dessutom till att överföra signaler från transmittorsubstansen glutamat mellan nervceller (bild 2).
Förbindelse mellan två nervceller (synaps) som kommunicerar med signalsubstansen glutamat. Neurochondrin ”hjälper” glutamat-receptorn vid överföring av signalen till mottagarcellen. Nedsatt neurochondrin-funktion, som hos de undersökta barnen, hämmar signalöverföringen.
Hos barn med mutationerna försämras glutamatsignaleringen. Mutationerna orsakar därför flera problem under hjärnans utveckling som leder till försenad språkutveckling, mild till svår utvecklingsstörning och epilepsi.
– Vi har lagt en pusselbit till förståelsen av hjärnans tidiga utveckling och för dess normala funktioner. De flesta patienter med neurochondrin-mutationer kan upptäckas innan de har fyllt två år. Om vi redan innan dess kan hjälpa överföringen av glutamatsignaleringen kan vi kanske lindra utvecklingen av till exempel epilepsi i utvalda fall. Utifrån det vi vet nu kan vi också försöka stimulera bildningen av vissa nervutskott i nervcellerna.
Dahl, Niklas et al.: Mono-allelic and Bi-allelic Variants in NCDN Cause Neurodevelopmental Delay, Intellectual Disability and Epilepsy , The American Journal of Human Genetics, DOI: 10.1016/j.ajhg.2021.02.015 , https://www.cell.com/ajhg/fulltext/S0002-9297(21)00057-4.
Nya data om vaccinationer av personer med MS
Resultat från två vaccinstudier presenterades på ACTRIMS 2021. De visar att personer med skovvis MS som behandlats med Mavenclad bildar antikroppssvar efter vaccination med vanliga vacciner.
- En retrospektiv analys av studien MAGNIFY-MS visar att patienter får skyddande antikroppsnivåer i minst sex månader efter säsongsinfluensa- och varicella zoster-virus (VZV) vacciner, oavsett vaccinationstidpunkt i förhållande till Mavenclad-dosering
- Initiala resultat från CLOCK-MS-vaccinstudien visar skyddande antikroppsnivåer fyra veckor efter vaccination hos MS-patienter som behandlas med Mavenclad
- I båda studierna upprätthölls eller ökade antikroppsnivåerna oberoende av antalet lymfocyter
- Kunskapen är bristfällig om vaccination av personer med MS som behandlas med immunhämmande läkemedel leder till förbättrat infektionsförsvar. Frågan har fått ny aktualitet i samband med den nuvarande pandemin och den växande tillgängligheten av COVID-19-vacciner”, säger Jan Lycke, professor, överläkare i neurologi, Sahlgrenska Universitetssjukhuset.
- Även om den nya informationen baseras på en liten kohortstudie av patienter som fått vaccin mot säsongsinfluensa eller bältros/varicella zoster, ger den preliminära bevis för att patienter som tar Mavenclad kan bygga upp och upprätthålla skyddande nivåer av antikroppar mot dessa infektioner efter vaccination.
- I studien förstärktes immunsvaret efter vaccination mot infektioner som studiepersonerna redan hade viss immunitet mot. Covid-19 är en ny infektion och förhoppningsvis kan nuvarande vaccinationsprogram ge skydd mot covid-19 även hos Mavenclad-behandlade individer.
Den retrospektiva analysen utfördes för att utvärdera antikroppssvaret mot säsongsinfluensa (n = 12) och bältros/VZV vaccinationer (n = 3) hos patienter som behandlats med Mavenclad. Blodprover som tagits före och efter vaccination undersöktes. Hos patienter som fick säsongsinfluensavaccinet bibehölls eller ökade skyddande antikroppsnivåer i minst sex månader oberoende av antalet lymfocyter uppmätt vid vaccinationstidpunkten år 1 eller 2 av Mavenclad-behandlingen. Hos patienter som fick VZV-vaccinet före Mavenclad år 1 upprätthölls skyddande VZV-antikroppsnivåer i sex månader efter initiering med Mavenclad, trots sänkning av lymfocyter. Dessa resultat var oberoende av när patienterna fick vaccinet i förhållande till Mavenclad-behandlingen.
I CLOCK-MS-studien hade tre patienter med skovvis förlöpande MS (RRMS) fått minst en dos Mavenclad innan de fick ett influensavaccin. Seroprotektiva antikroppsnivåer ökade fyra veckor efter vaccination hos alla tre patienterna. Detta, trots att två av dessa patienter, som hade fått behandling med Mavenclad två och fyra månader före vaccination, hade lymfopeni (lågt antal lymfocyter) vid vaccinationstidpunkten.
- I en ständigt föränderlig värld där en pandemi sannolikt kommer att finnas under överskådlig framtid är det viktigt att bedöma effekterna av vanliga icke-levande vaccinationer hos dem som tar sjukdomsmodifierande terapier, säger Anders Wesslau, ansvarig för Mercks verksamhet i Sverige.
- Dessa nya observationer visar på vårt engagemang för att täcka kunskapsluckor som är kliniskt relevanta och betydelsefulla för patienter och de som arbetar inom MS-vården.
Protein i hjärnan kan användas i mediciner mot flera allvarliga sjukdomar
Proteiner brukar kallas för kroppens byggstenar – med all rätt. Nästan allting som pågår i kroppen har med proteiner att göra på ett eller annat sätt. I en ny avhandling i kemi zoomar Dick Sjöström in på ett specifikt transport-protein som vi skulle kunna använda för att utveckla mediciner och behandling mot bland annat hjärntumörer, Alzheimers, malaria och högriskklassade virus om vi lär oss mer om det.
Transferrinreceptor 1 är ett transportsystem för att leverera järn till cellerna. Den är särskilt intressant då den obehindrat tar sig förbi blod-hjärnbarriären. Barriären är ett livsviktigt försvar för hjärnan, men den hindrar också de flesta mediciner från att nå hjärnan om de ges som vi är vana att få mediciner, exempelvis i tabletter eller med spruta till blodet.
Barriären hindrar alltså utvecklingen för de flesta lovande medicinerna mot bland annat hjärntumörer, Alzheimers, Parkinsons och Huntingtons sjukdom. I framtiden hoppas man kunna utnyttja transferrinreceptor 1 för att leverera olika typer av mediciner och antikroppar direkt till hjärnan.
– Min forskning har flera infallsvinklar, men transferrinreceptorn är central i hela projektet, säger
Dick Sjöström, doktor i kemi på institutionen för kemi och biomedicin vid Linnéuniversitetet. Det är en livsviktig transportör för att järn ska kunna ta sig in i våra celler, men den är också porten in i celler för några av världens högst riskklassade virus och en av de vanligaste malaria-parasiterna.
Egendesignade proteiner
Det är alltså möjligt för vissa patogener att binda till receptorn och på så sätt komma förbi blod-hjärnbarriären, men det är också möjligt att själv designa proteiner som fäster på receptorn, och det kommer i framtiden kunna användas i medicinska syften.
– Vi har dels tittat på vilka mekanismer som gör att vissa virus binder till receptorn, men också själva designat proteiner som vi lyckats binda till receptorn, säger Dick Sjöström. Jag tror att våra specialdesignade proteiner som binder till transferrinreceptorn kommer bli viktiga i framtiden, både för att fortsätta lära oss mer om hur transportmekanismerna fungerar men även för att kunna använda receptorn som ett transportsystem för olika typer av mediciner som måste till hjärnan – till exempel vid Parkinson, Alzheimer och hjärntumörer.
Delen av receptorn som virusen och malariaparasiten binder till har också kopplats bort från resten av receptorn och designats för att kunna renas fram ur bakterier, med tanken att kunna utveckla den receptorn till läkemedel mot virusen och malaria-parasiten.
Avhandlingen har som syfte att öka vår förståelse för transferrinreceptorn och att utveckla nya verktyg i studerandet av den. Sammantaget har de här studierna bidragit till den samlade kunskap som finns om transferrinreceptorn och gett nya verktyg för fortsatt förståelse av den.
Länk till avhandlingen:
Design and engineering of human transferrin receptor 1 and its binding proteins
Göran Gustafssonpriset för forskning av hjärnceller
Goncalo Castelo-Branco vid institutionen för medicinsk biokemi och biofysik får Göran Gustafssonpriset i medicin, ”för hans nyskapande analys av oligodendrocyter och nervcellers myelinisering i hälsa och sjukdom”. Han är neurobiolog och har gjort banbrytande upptäckter om hur cellerna i hjärnan fungerar. Hans upptäckter har skett genom användning av ny teknik som gör det möjligt att analysera enskilda celler och fastställa den genetiska aktiviteten i var och en av dem.
Han forskar om en viss typ av hjärnceller, oligodendrocyter, som producerar fettämnet myelin. Myelinet fungerar som isolering av nervtrådarna och gör så att signalerna i centrala nervsystemet kan färdas mer effektivt. När immunförsvarets vita blodkroppar angriper oligodendrocyterna vid sjukdomen c tappar de förmågan att producera myelin och nervimpulserna leds inte längre på rätt sätt.
Hittills har behandlingar mot MS varit fokuserade på att hämma immunförsvaret. Nu tror Goncalo Castelo-Brancos forskargrupp att det istället skulle vara möjligt att utveckla behandlingar som stimulerar oligodendrocyternas förmåga att tillverka nytt myelin.
– På senare tid har vi också sett att oligodendrocyterna vid vissa tillfällen får egenskaper som liknar immunceller och detta kan påverka hur immuncellerna agerar vid sjukdomen. Vad det spelar för roll vid MS vet vi inte ännu men vill undersöka i framtiden, säger Goncalo.